Inhoud
Theoretische prestatie is een term die in de chemie wordt gebruikt om het maximale product te beschrijven dat kan worden verwacht bij een chemische reactie. U moet beginnen met een uitgebalanceerde chemische vergelijking en het beperkende reagens definiëren. Door de hoeveelheid te gebruiken reagens te meten, kunt u de hoeveelheid van het product berekenen. Het vertegenwoordigt op zijn beurt de theoretische prestatie van de vergelijking. In een echte situatie zult u waarschijnlijk een klein verlies lijden vanwege de inefficiëntie van het experiment zelf.
Stappen
Methode 1 van 2: Bepaling van het beperkende reagens
Begin met de uitgebalanceerde chemische vergelijking. Een chemische vergelijking is als een recept.Het toont de reagentia (aan de linkerkant) die reageren op de gevormde producten (aan de rechterkant). Een correct uitgebalanceerde vergelijking toont een aantal atomen die binnenkomen gelijk aan dat van de reagentia die als producten naar buiten komen.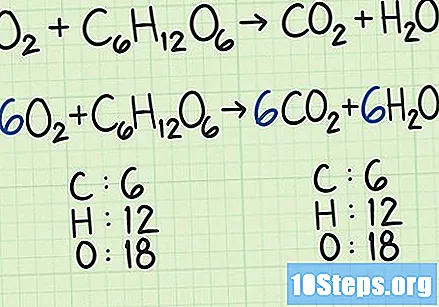
- Beschouw bijvoorbeeld de eenvoudige vergelijking. Er zijn zowel links als rechts twee waterstofatomen, maar er komen twee zuurstofatomen binnen als reactanten en slechts één verlaat het eindproduct aan de rechterkant.
- Om de vergelijking in evenwicht te brengen, verdubbelt u de hoeveelheid product :.
- Controleer het saldo. Deze verandering corrigeerde zuurstof, dat nu twee atomen aan beide kanten van de vergelijking heeft. Er zijn nu echter twee waterstofatomen aan de linkerkant en vier aan de rechterkant.
- Verdubbel de hoeveelheid waterstof in het reagens. Dit zal de vergelijking aanpassen aan. Deze uitwisseling heeft nu aan weerszijden vier waterstofatomen en twee zuurstofatomen. De vergelijking is in evenwicht.
- In een iets gecompliceerder voorbeeld kunnen zuurstof en glucose reageren om kooldioxide en zuurstof te vormen :. In deze vergelijking heeft elke zijde precies zes koolstofatomen (C), 12 waterstof (H) en 18 zuurstof (O). De vergelijking is in evenwicht.
- Lees deze gids als u meer wilt weten over het in evenwicht brengen van chemische vergelijkingen.

Bereken de molaire massa van elk reagens. Zoek met behulp van het periodiek systeem of een andere referentiebron naar de molaire massa van elk atoom van de betrokken verbindingen. Tel ze bij elkaar op om de molaire massa van elke reagensverbinding te vinden, zodat het voor individuele moleculen is. Beschouw opnieuw de vergelijking die zuurstof en glucose omzet in kooldioxide en zuurstof :.- In dit voorbeeld bevat een zuurstofmolecuul () twee zuurstofatomen.
- De molaire massa van een zuurstofatoom is ongeveer 16 g / mol (indien nodig kunnen nauwkeurigere waarden worden gevonden).
- Twee zuurstofatomen × 16 g / mol per atoom = 32 g / mol van
- Het andere reagens, glucose () heeft een molecuulgewicht gelijk aan
. - Om deze stap in meer detail te bekijken, kunt u de gids lezen over het berekenen van de molaire massa.

Reken de hoeveelheid van elk reagens om van gram naar mol. In een echte situatie weet u de massa in gram van elk reagens dat wordt gebruikt. Deel deze waarde door de molaire massa van de verbinding om deze in molen om te zetten.- Stel dat u bijvoorbeeld bent begonnen met 40 gram zuurstof en 25 gram glucose.
- .
- .
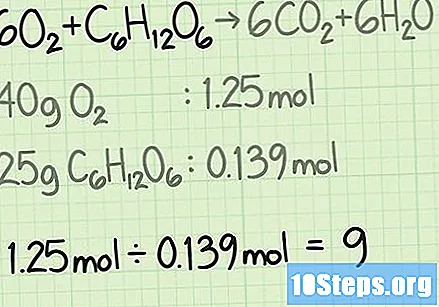
Bepaal het aandeel reagentia. De mol is een hulpmiddel dat in de chemie wordt gebruikt om moleculen te tellen op basis van hun massa. Bij het bepalen van het aantal mol zuurstof en glucose weet je met hoeveel moleculen elk begonnen is. Om de verhouding tussen de twee te berekenen, deelt u het aantal mol van het ene reagens door het aantal mol van het andere.- In dit voorbeeld begin je met 1,25 mol zuurstof en 0,139 mol glucose. De zuurstofsnelheid met betrekking tot glucose zal dus zijn. Deze verhouding betekent dat je negen keer meer zuurstofmoleculen hebt dan glucosemoleculen.
Vind de ideale verhouding voor de reactie. Bekijk de evenwichtige reactievergelijking. De coëfficiënt voor elk molecuul geeft de snelheid van moleculen aan die nodig zijn om deze reactie te laten plaatsvinden. Als u precies de snelheid gebruikt die door deze formule wordt gegeven, moeten beide reagentia gelijkelijk worden gebruikt.
- In deze vergelijking worden de reagentia gegeven als. De coëfficiënten geven aan dat er zes moleculen zuurstof nodig zijn voor elk molecuul glucose. De ideale verhouding zal in dit geval dus gelijk zijn aan.
Vergelijk snelheden om het beperkende reagens te vinden. Bij de meeste chemische reacties zal een van de reagentia eerder worden verbruikt dan de andere. Degene die als eerste wordt gebruikt, wordt een beperkend reagens genoemd. Het bepaalt hoe lang de chemische reactie kan plaatsvinden en wat de theoretische opbrengst is. Vergelijk de twee berekende snelheden om het beperkende reagens te identificeren: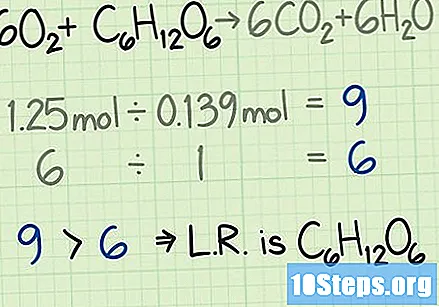
- In dit voorbeeld begin je met negen keer meer zuurstof dan glucose bij het meten van het aantal moedervlekken. De formule geeft aan dat de ideale verhouding gelijk is aan zes keer de hoeveelheid zuurstof ten opzichte van glucose. Je hebt dus meer zuurstof dan je nodig hebt. Het andere reagens, in dit geval glucose, is het beperkende reagens.
Methode 2 van 2: Bepalen van de theoretische opbrengst
Analyseer de reactie opnieuw om het gewenste product te verkrijgen. De rechterkant van een chemische vergelijking toont de producten die door de reactie zijn gevormd. De coëfficiënten van elk, in een uitgebalanceerde reactie, geven u de hoeveelheid aan die u in moleculaire verhoudingen kunt verwachten. Elk product heeft een theoretische opbrengst, die de hoeveelheid product aangeeft die naar verwachting bij een perfect efficiënte reactie zal worden verkregen.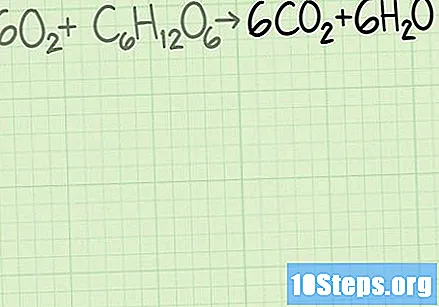
- Als je het bovenstaande voorbeeld voortzet, analyseer je de reactie. De twee producten aan de rechterkant zijn kooldioxide en water.
- U kunt met elk van de producten beginnen bij de berekening van de theoretische opbrengst. In sommige gevallen bestaat deze zorg met betrekking tot slechts één van de producten. In die situatie is dat de eerste om mee te beginnen.
Noteer de molhoeveelheid beperkend reagens. U dient altijd de molhoeveelheid reagens te vergelijken met de molhoeveelheid product. Als de vergelijking rekening houdt met de massa van beide, zal uw resultaat niet correct zijn.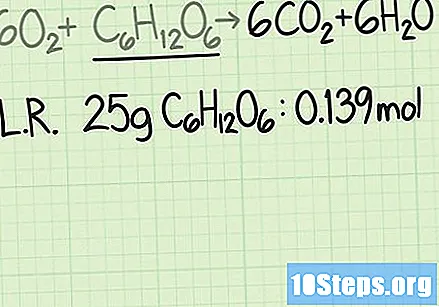
- In het bovenstaande voorbeeld is glucose het beperkende reagens. Uit de berekeningen van de molmassa bleek dat de aanvankelijke 25 gram glucose gelijk is aan 0,139 mol glucose.
Vergelijk de snelheid van moleculen in het product en het reagens. Ga terug naar de gebalanceerde vergelijking. Verdeel het gewenste aantal moleculen van het product door het aantal moleculen van het beperkende reagens.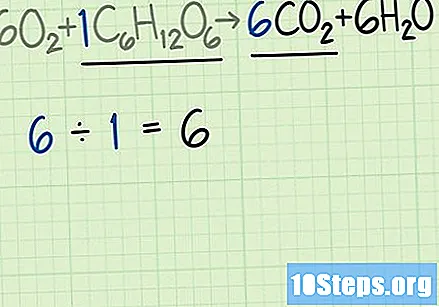
- De gebalanceerde vergelijking zal in dit voorbeeld zijn. Deze vergelijking geeft aan dat men kan verwachten zes moleculen van het gewenste product, kooldioxide (), voor elk glucosemolecuul () te verkrijgen.
- De verhouding tussen kooldioxide en glucose is. Met andere woorden, deze reactie kan zes moleculen kooldioxide produceren voor elk molecuul glucose.
Vermenigvuldig de snelheid met de hoeveelheid beperkend reagens in mol. Het antwoord is gelijk aan de theoretische opbrengst, in mol, van het gewenste product.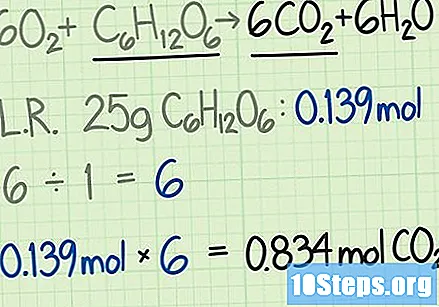
- In dit voorbeeld is de 25 gram glucose gelijk aan 0,139 mol glucose. De verhouding tussen kooldioxide en glucose is 6: 1. Men kan verwachten zes keer de hoeveelheid mol kooldioxide te verkrijgen in vergelijking met de aanvankelijke glucose.
- De theoretische opbrengst aan kooldioxide zal gelijk zijn aan
.
Zet het resultaat om in gram. Dit is een omgekeerde stap ten opzichte van de vorige, bij het berekenen van het aantal mol of het reagens. Als je weet hoeveel mollen je kunt verwachten, vermenigvuldig je je met de molaire massa van het product om de theoretische opbrengst in grammen te bepalen.
- In dit voorbeeld is de molaire massa ongeveer 44 g / mol (de molaire massa van koolstof is gelijk aan ~ 12 g / mol en die van zuurstof, van ~ 16 g / mol, in totaal).
- Vermenigvuldig 0,834 mol. De theoretische opbrengst van het experiment zal gelijk zijn aan 36,7 gram.
Herhaal desgewenst de berekening voor het andere product. Bij verschillende experimenten maakt u zich mogelijk alleen zorgen over de prestaties van een product. Als u de theoretische prestaties van beide wilt vinden, herhaalt u het proces.
- In dit voorbeeld is het tweede product water, of. Volgens de gebalanceerde vergelijking wordt verwacht dat zes watermoleculen worden verkregen uit zes glucosemoleculen. Dit is een verhouding van 1: 1. Dus als je begint met 0,139 mol glucose, krijg je 0,139 mol water.
- Vermenigvuldig de hoeveelheid mol water met je molaire massa. De molaire massa zal gelijk zijn aan. Door het product te vermenigvuldigen, wordt het resultaat verkregen. De theoretische opbrengst aan water zal in dit experiment gelijk zijn aan 2,50 gram.